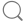| 序号 | 研究机构 | 分析师 | 投资评级 | 报告标题 | 更新日 | |
| 上期评级 | 评级变动 | |||||
| 1 | 中邮证券 | 盛丽华,陈灿 | 维持 | 买入 | 盈利稳步提升,全年收入指引下限上调 | 2025-11-21 |
百济神州(688235)
事件
公司公布2025年三季报,25Q1-Q3收入为276.0亿元(+44.2%)归母净利润为11.4亿元(去年同期为-36.9亿元),扣非归母净利润为9.7亿元(去年同期为-39.9亿元)。25Q3收入为100.8亿元(+41.1%),归母净利润为6.9亿元(去年同期为-8.1亿元),扣非归母净利润为7.1亿元(去年同期为-8.7亿元)。公司同时将全年收入指引从此前的50-53亿美元调整至51-53亿美元、全年GAAP经营利润为正的指引不变。
核心观点
25Q3泽布替尼突破10亿美元,费用环比稳中略降
前三季度拆分来看,泽布替尼全球收入达27.8亿美元(+53.2%)其中美国19.9亿美元(+48.8%),主要得益于各适应症需求的强劲增长,新患份额持续领先;欧洲4.3亿美元(+75.0%),得益于所有主要欧洲市场的份额提升;中国2.6亿美元(+359%);其他地区1.1亿美元(+133.3%)。前三季度替雷利珠单抗收入5.6亿美元(+18.9%)、安进产品国内收入合计3.7亿美元(+48.4%),主要得益于地舒单抗安加维销量增加。
单Q3来看,泽布替尼全球收入10.4亿美元(+50.8%),其中美国7.4亿美元(+46.6%)、欧洲1.6亿美元(+67.8%)、中国0.9亿美
元(+36.2%)、其他地区0.5亿美元(+116.6%)。25Q3替雷利珠单抗收入1.9亿美元(+16.7%)、安进产品国内收入1.3亿美元(+31%,其中地舒单抗安加维0.84亿美元,+32.8%、贝林妥欧单抗0.3亿美元,+50.8%)。
25Q3产品毛利率85.9%(+3.1pct),延续Q1和Q2的趋势。研发费用5.2亿美元(+5.5%),环比Q2略降;销售、行政及一般费用环比也有下降。Q3营业利润达到1.6亿美元,环比Q2再上一个台阶。
26H1催化丰富、CDK4抑制剂重点转向一线
Bcl2抑制剂索托克拉:预计26H1启动ZS固定剂量方案对比AV方案的III期试验,ASH数据来看有望成为BIC;
BTK CDAC/BGB-16673:预计26H1读出用于后线CLL的II期潜在关键试验数据;
CDK4抑制剂/BGB-43395:预计26H1启动用于1L BC的III期试验(不再开发2L);
其他在研项目:B7H4ADC完成OC、BC和EC的剂量递增;FGFR2bADC、Pan-KRAS抑制剂以及EGFR CDAC等早研项目POC数据由此前25H2读出变更为26H1;GPC3/4-1BB双抗在后线HCC展现疗效。
盈利预测与投资建议
预计公司25/26/27年收入分别为371.0/471.5/581.8亿元,同比增长36.3%/27.1%/23.4%;归母净利润为8.2/40.7/80.7亿元,同比增长116.5%/394.5%/98.3%,对应PE为523/106/53倍。公司为创新药出海龙头企业,全球商业化能力突出、在研管线即将进入收获期维持“买入”评级。
风险提示:
产品销售不及预期;新药临床进度不及预期;新药临床数据不及预期。 |
||||||
| 2 | 东吴证券 | 朱国广,张翀翯 | 维持 | 买入 | 2025年三季报点评:盈利大幅跃升,泽布替尼引领增长 | 2025-11-13 |
百济神州(688235)
投资要点
事件:2025Q3公司营收14.12亿美金(前三季度累计38.45亿美金),同比+41%,产品收入14.0亿美金,同比+41%。主要得益于泽布替尼在欧美市场的持续放量(10亿美金)及百泽安、安进授权产品的协同增长。25Q3GAAP口径毛利率85.9%(+3.1pct),主要因为泽布替尼在产品销售中占比的提高和整体生产效率的提高,GAAP口径净利润1.25亿美金(同比扭亏为盈),经调整净利润3.04亿美金(同比+489%)。上调2025年收入指引为51-53亿美金(前值50-53),业绩增长确定性进一步增强。
催化剂:1)索托克拉(BCL2抑制剂)获得FDA BTD认定用于治疗R/R MCL,公司计划在即将召开的学术大会上公布全部数据,年底前向FDA提交NDA;针对R/R WM注册2期临床完成FPI;与泽布替尼联合用药对比阿可替尼+维奈克拉(AV)的3期临床试验,公司预计26H1启动患者入组;用于治疗MM的3期临床试验,公司预计26H2启动患者入组。2)BGB-16673(BTK CDAC):R/R CLL的注册2期持续入组,26H1有望读出数据,以加速上市申请;头对头礼来的匹妥布替尼针对R/R CLL的3期临床完成FPI;3)BGB-43395(CDK4抑制
剂):潜在同类最佳,公司预计2026H1启动针对HR+/HER2-BC的一线和二线注册3期临床,计划12月SABCS会议更新数据;4)泽尼达妥单抗(HER2双抗):公司预计25H2读出治疗1L HER2+GC的3期数据;5)BGB-45035(IRAK4CDAC):25H2治疗中重度风湿关节炎2期完成FPI,公司预计26H1启动治疗AD的2期临床。
盈利预测与投资评级:核心产品泽布替尼持续放量,实体瘤管线逐步迈入收获期,我们预计公司未来三年营收将保持增长态势。规模效应驱动费用管控升级,公司有望在近几年实现利润的快速释放。我们将2025-2027年的归母净利润从8.13/41.68/95.43亿元分别上调至21.15/52.58/96.81亿元,对应2025-2027年PE估值为200/80/44X。公司作为国内创新药龙头,临床开发效率卓越,全球商业化能力突出,成长确定性较高,维持“买入”评级。
风险提示:新药研发及审批进展不及预期,药品销售不及预期,产品竞争格局加剧,政策的不确定性,全球业务相关风险等。 |
||||||
| 3 | 中国银河 | 程培,闫晓松 | 维持 | 买入 | 百济神州2025年三季报业绩点评:泽布替尼销售强劲,研发动能持续提升 | 2025-11-11 |
百济神州(688235)
事件:2025年11月7日,百济神州发布2025年三季度业绩报告,2025年前三季度公司实现营业收入275.95亿元(+44.2%),其中产品收入273.14亿元(+43.9%);归母净利润11.39亿元,同比扭亏。2025Q3单季度公司实现营业收入100.77亿元(+41.1%),其中产品收入99.54亿元(+40.6%)。
泽布替尼销售持续强劲,全年业绩指引再度上调。2025年第三季度泽布替尼全球销售额74.23亿元(+51.0%),营收规模在全球同类BTK抑制剂中排名第一。其中美国市场销售52.66亿元(+46.9%),主要得益于血液肿瘤领域需求增长强劲及净定价带来适度利好。泽布替尼凭借同类最佳的优势,在美国新患市场份额始终保持领先地位,目前美国已成为公司最大市场。欧洲市场销售11.65亿元(+68.2%),在德国、意大利、西班牙、法国和英国等主要国家市场份额持续提升。中国销售额6.61亿元(+36.2%),市场领先地位稳固。第三季度替雷利珠单抗销售额13.63亿元(+16.6%),新获批适应症纳入医保目录带来新增患者。得益于核心产品放量及生产效率提升,公司再度上调全年营业收入指引为362亿元至381亿元,盈利能力加速改善。
全球研发动能持续提升,多项早期管线完成概念验证。公司全球研发布局持续推进,在血液瘤领域,索托克拉用于R/R MCL适应症已获得FDA突破性疗法认定,治疗R/R WM注册性Ⅱ期临床已完成患者入组。BTK CDAC定位后线最佳疗法,“头对头”匹妥布替尼用于R/R CLL全球Ⅲ期临床完成首例入组。在实体瘤领域,B7-H4ADC、PRMT5联用MAT2A、GPC3/4-1BB双抗等早期管线已完成概念验证,塔拉妥单抗一线治疗广泛期小细胞肺癌全球Ⅲ期已完成首例入组。在免疫治疗领域,IRAK4CDAC治疗中重度类风关Ⅱ期研究已完成首例入组,BTK CDAC用于慢性自发性荨麻疹Ⅰb期研究已完成首例入组,早研储备管线正加速兑现。
投资建议:百济神州作为聚焦创新药研发生产和全球商业化的龙头企业,其核心产品具备同类最佳特质,血液瘤领导地位进一步巩固,多项自主研发管线即将迎来价值拐点。我们预计公司2025-2027年的营业收入分别为368.04/462.79/536.50亿元;归母净利润分别为10.28/44.39/81.14亿元,经过DCF估值模型测算,我们认为公司合理市值区间为3590.42-5765.77亿元。维持“推荐”评级。
风险提示:研发管线进展不及预期的风险;产品商业化不及预期的风险;市场竞争加剧的风险;政策变动的风险。 |
||||||
| 4 | 中邮证券 | 盛丽华,陈灿 | 首次 | 买入 | 泽布替尼环比稳定增长,Q2维持GAAP转正势头 | 2025-09-30 |
百济神州(688235)
事件
公司公布2025年半年报,上半年实现营业收入175.2亿元(+46.0%)、归母净利润4.5亿元(去年同期为-28.8亿元)、扣非归母净利润2.6亿元(去年同期为-31.3亿元);25Q2实现营业收入94.7亿元(+42.7%)、归母净利润5.4亿元(去年同期为-9.7亿元)、扣非归母净利润4.6亿元(去年同期为-10.8亿元)。公司同时将全年收入指引从此前的49-53亿美元上调至50-53亿美元、全年GAAP经营利润为正的指引不变。
核心观点
25Q2泽布替尼环比稳定增长,地舒单抗快速放量
25H1拆分来看,泽布替尼全球收入达17.4亿美元(+54.7%),其中美国12.5亿美元(+50.1%),继续保持新患者治疗领域市场份额的领先地位;欧洲2.7亿美元(+79.7%),得益于所有主要欧洲市场的份额提升;中国1.6亿美元(+35.8%);其他地区0.6亿美元(+147.2%)25H1替雷利珠单抗收入3.6亿美元(+20.1%),国内市场地位相对稳定;安进产品国内收入合计2.4亿美元(+48.4%),主要得益于地舒单抗安加维销量增加。
单Q2来看,泽布替尼全球收入9.5亿美元(+49.0%),其中美国6.8亿美元(+42.6%)、欧洲1.5亿美元(+84.9%)、中国0.8亿美元(+30.8%)、其他地区0.3亿美元(+149.0%)。25Q2替雷利珠单抗收入1.9亿美元(+22.2%)、安进产品国内收入合计1.3亿美元(+40.2%)
新品研发快速推进,期待ADC平台的POC数据
Bcl2抑制剂索托克拉:国内单药用于经治CLL/SLL和MCL的NDA已纳入优先审评;联合泽布替尼固定剂量头对头维奈克拉+奥妥珠单抗固定剂量用于初治CLL的III期Celestial301试验已完成入组,联合泽布替尼头对头泽布替尼用于经治MCL的III期Celestial302联合奥妥珠单抗头对头维奈克拉+奥妥珠单抗用于经治CLL的303试验已启动,25H2预计基于II期数据全球申报经治MCL的NDA。
BTK CDAC:25H1单药头对头研究者方案用于经治CLL的III期CaDAnCe302试验已启动,25H2预计启动单药头对头匹妥布替尼用于经治CLL的III期CaDAnCe304试验,26年预计读出单药用于经治CLL的潜在关键性II期于CaDAnCe101试验数据。
其他研发进展:CDK4抑制剂已于25H1披露早期活性,26年预计启动用于2L和1L HR+/HER2-BC的III期试验。B7H4ADC预计26年启动III期。预计25H2披露泛KRAS抑制剂、EGFR CDAC以及B7H3ADC等众多产品的POC数据。
盈利预测与投资建议
预计公司25/26/27年收入分别为371.0/471.5/581.8亿元,同比增长36.3%/27.1%/23.4%;归母净利润为8.2/40.7/80.7亿元,同比增长116.5%/394.5%/98.3%,对应PE为564/114/58倍。公司为创新药出海龙头企业,全球商业化能力突出、在研管线即将进入收获期首次覆盖,给予“买入”评级。
风险提示:
产品销售不及预期;新药临床进度不及预期;新药临床数据不及预期。 |
||||||
| 5 | 东吴证券 | 朱国广,张翀翯 | 维持 | 买入 | 2025年中报点评:业绩超预期,上调全年业绩指引 | 2025-09-02 |
百济神州(688235)
投资要点
事件:2025H1公司营收24.3亿美金(25Q1=11.2亿,25Q2=13.2亿),同比+42%,产品收入24.1亿美金(25Q1=11.1亿,25Q2=13.0亿),同比+43.8%。主要得益于泽布替尼在美国的领先地位和在欧洲等地销售持续增长。25Q2泽布替尼收入9.7亿美金,同比+53%(环比+23%),GAAP口径毛利率87.4%(+2.4pct),研发费用率39.8%(-9pct),销售及管理费用率41%(-16pct),GAAP口径持续盈利0.94亿美金,经调整净利润2.53亿美金。上调2025年收入指引50-53亿美金(前值49-53亿美金)。
重要催化剂:Sonrotoclax(BCL2抑制剂):2025H2针对r/r MCL的数据读出并报产;16673(BTK CDAC):全球首创,解决BTKi耐药问题。获美国FDA快速通道认定,R/R CLL的注册2期持续入组,26年读出数据。2025H2启动头对头礼来的匹妥布替尼针对R/R CLL的3期临床。针对R/R WM注册2期临床首例患者完成入组;实体瘤:CDK4i:潜在同类最佳,针对HR+/HER2-BC的一线和二线注册3期临床预计2026年启动;PRMT5i+MATA2i:25H2联合用药首例患者入组。炎症和免疫:IRAK4CDAC:2025H2完成特应性皮炎和结节性痒疹的2期入组中,读出poc数据。
盈利预测与投资评级:考虑到核心产品销售持续增长,实体瘤管线逐步进入收获期。我们预计公司整体营收未来三年保持稳健增长,三费费用控制合理,近几年有望快速释放利润。我们将2025-2026年的归母净利润4.03亿元和35.9亿元分别上调至8.13亿元和41.68亿元。预计2027年归母净利润为95.43亿元,对应2025-2027年PE估值为489/95/42X。公司作为国内创新药龙头,临床开发效率卓越,全球商业化能力突出,成长确定性较高,维持“买入”评级。
风险提示:新药研发及审批进展不及预期,药品销售不及预期,产品竞争格局加剧,政策的不确定性,全球业务相关风险等。 |
||||||
| 6 | 东莞证券 | 谢雄雄 | 调低 | 增持 | 2025年半年报点评:Q2业绩保持稳定增长 | 2025-09-01 |
百济神州(688235)
投资要点:
事件:公司发布2025年半年度报告。2025年半年度,公司实现营业收入175.16亿元,同比增长46.03%;实现归属于上市公司股东的净利润4.50亿元;实现扣非归母净利润2.61亿元。
点评:
公司Q2业绩保持稳定增长。分季度来看,公司2025年Q2实现营收94.70亿元,同比增长42.69%,环比增长17.68%,实现归母净利润5.44亿元Q2业绩保持稳定增长。产品收入的增长主要得益于自主研发产品百悦泽。(泽布替尼胶囊)和安进授权产品以及百泽安(替雷利珠单抗注射液)的销售增长。2025年半年度,百悦泽全球销售额总计125.27亿元,同比增长56.2%,在血液肿瘤领域进一步巩固领导地位。其中,美国销售额总计89.58亿元,同比增长51.7%,主要得益于该产品在所有适应症领域强劲的需求增长,以及净定价带来的适度利好。凭借差异化且同类最佳的临床特征,百悦泽继续在BTK抑制剂药物中保持新患者市场份额的领先地位。2025年半年度,百泽安的销售额总计26.43亿元,同比增长20.6%。百泽安销售额的增长,主要得益于该产品在中国获批新适应症纳入医保所带来的新增患者需求以及药品进院数量的增加。百泽安在中国PD-1市场取得领先的市场份额。
公司加快推进研发创新。公司建立了自主的全球临床开发能力,在全球拥有一支超过3,700人组成的自主临床团队,这让公司能够摆脱传统CRO模式,并以相比同行业企业更快的速度、更低的成本在全球范围内自主开发药物,同时能够保持质量。公司自成立以来,始终致力于解决长期困扰制药行业投资回报的现状,注重建立独特且难以复制的竞争优势,以应对行业挑战。在小分子和抗体药物的转化发现方面颇具实力,其中包括三种自主研发的平台技术:抗体偶联药物(ADC)、多特异性抗体和嵌合式降解激活化合物(CDAC)。公司预计今年将在抗体偶联药物、多特异性抗体和靶向蛋白降解剂等广泛的产品组合中进行多项概念验证数据读出。未来18个月内,公司预计将在血液肿瘤和实体瘤管线中迎来超过20项里程碑进展。
给予公司“增持”评级。预计公司2025-2026年EPS分别为0.50元和2.35元,公司作为国内创新药龙头企业,创新药业务保持快速增长,加速全球布局。给予对公司“增持”评级。
风险提示。产品研发进度不及预期风险和产品销售不及预期风险等。 |
||||||
| 7 | 中国银河 | 程培,闫晓松 | 维持 | 买入 | 百济神州2025年中期报告业绩点评:泽布替尼持续放量,全年业绩指引上调 | 2025-09-01 |
百济神州(688235)
事件:2025年8月30日,百济神州发布2025年中期业绩报告,2025年上半年公司实现营业收入175.18亿元(+46.03%),其中产品收入173.60亿元(+45.78%);归母净利润4.50亿元,扣非归母净利润2.61亿元,同比扭亏;经营性现金流16.31亿元。2025Q2单季度公司实现营业收入94.70亿元(+42.69%);归母净利润5.44亿元;扣非归母净利润4.57亿元,同比扭亏;经营性现金流18.24亿元。
泽布替尼放量超预期,公司上调全年业绩指引。2025年上半年泽布替尼全球销售额125.27亿元(+56.2%),该产品在血液瘤领域需求增长强劲,同时净定价带来适度利好;其中美国销售额89.58亿元(+51.7%),在美国BTK抑制剂市场份额连续两季度位居第一,新患处方数量保持领先优势。欧洲销售额19.18亿元(+81.4%),在欧洲多个市场持续推广销售,其中德国、意大利、西班牙等主要市场份额持续提升。中国销售额11.92亿元(+36.5%),销售持续增长且市场领先地位稳固。替雷利珠单抗上半年销售26.43亿元(+20.6%),国内新获批适应症纳入医保后放量增长,药品进院数量进一步增加。得益于产品收入增长以及生产效率提升,公司上调全年营业收入指引为358亿元至381亿元,毛利率为80%至90%中高位区间,经营性现金流扣除购建固定资产等资本性支出后预计净额为正。
全球研发稳步推进,即将迎来多项里程碑催化。未来18个月内,公司预计在血液瘤和实体瘤管线迎来超过20项里程碑进展。血液瘤领域,公司布局BTK+BCL-2+BTK CDAC实现CLL治疗全线覆盖,其中BCL-2联合BTK一线治疗CLL的全球三期已完成全部患者入组,R/R MCL全球三期已完成首例入组;BCL-2单药治疗R/R CLL和R/R MCL的上市申请在中国获受理。BTKCDAC治疗R/R CLL全球三期已完成首例入组,定位后线最佳疗法。实体瘤领域,2025年下半年PRMT5与MAT2A联合治疗计划完成首例入组,IRAK4CDAC治疗AD二期临床计划完成首例入组,2026年CDK4即将启动HR+HER2-乳腺癌一线及二线治疗三期临床,公司多项实体瘤管线即将实现POC,早研储备迎来收获期。
投资建议:百济神州作为聚焦创新药研发生产和全球商业化的龙头企业,其核心产品具备同类最佳特质,血液瘤领导地位进一步巩固,多项自主研发管线即将迎来价值拐点。我们预计公司2025-2027年的营业收入分别为368.04/462.79/536.50亿元;归母净利润分别为10.28/44.39/81.14亿元,经过DCF估值模型测算,我们认为公司合理市值区间为3590.42-5765.77亿元。维持“推荐”评级。
风险提示:研发管线进展不及预期的风险;产品商业化不及预期的风险;市场竞争加剧的风险;政策变动的风险。 |
||||||
| 8 | 天风证券 | 杨松,曹文清 | 维持 | 买入 | 2025 Q2利润端大幅超预期,连续两季度GAAP利润为正 | 2025-08-21 |
百济神州(688235)
事件:
公司发布2025年半年度主要财务数据,2025H1总收入24.33亿美元,同比增长45%;GAAP净利润和经调整后净利润分别为9559万美元和3.89亿美元,均同比扭亏。2025Q2总收入13.15亿美元,同比增长42%;GAAP净利润为9432万美元,同比大幅扭亏;经调整GAAP净利润为2.53亿美元,同比增长985%。
各费用率逐季降低,降本增效,实现全面盈利
2025Q2研发费用为5.25亿美元,研发费用率为40%,同比减少9pct,环比减少3pct。非GAAP研发费用为4.44亿美元,对应费用率为34%,同比减少7pct,环比减少4pct。2025Q2GAAP销售及管理费用为5.38亿美元,对应费用率为41%,同比减少7pct,环比基本持平;非GAAP销售及管理费用为4.42亿美元,对应费用率为34%,同比减少6pct,环比减少2pct。与GAAP指标相比,2025Q2经调整后指标在研发费用和销售及管理费用中分别减去6439万和8616万美元的股权激励成本以及1645万和1009万美元的折旧费用,此外在销售及管理费用中还减去了1.1万美元的无形资产摊销费用。
2025Q2核心品种泽布替尼美国区和欧洲区均实现高速放量
2025Q2泽布替尼全球销售收入9.5亿美元,同比增长49%,环比增长20%。2025Q2,分地区来看,美国地区增速强劲,收入6.84亿美元,同比增长43%,环比增长21%,主要受益于其在所有适应症领域的需求增长、净定价带来的适度利好和BIC的差异化优势;欧洲地区收入1.5亿美元,同比增长85%,环比增长29%,主要得益于其在欧洲所有主要市场的市场份额均有所增加。中国地区销售额为0.83亿美元,同比增长31%,环比增长3%。
公司另一重要商业化产品替雷利珠单抗稳健增长。2025Q2总收入为1.94亿美元,同比增长22%,环比增长13%。
未来18个月内,将迎来多项重点里程碑进展
多项药物将进入III期临床或申报上市进程。2025H2:1)替雷利珠单抗用于早期非小细胞肺癌的新辅助和辅助治疗的上市申请有望获得欧盟委员会批准;2)替雷利珠单抗启动皮下制剂III期临床试验;3)索托克拉用于治疗R/R MCL的2期试验预计进行数据读出,并有望提交全球加速上市申请;4)BGB-16673(BTK CDAC)预计启动对比非共价BTK抑制剂匹妥布替尼用于治疗R/R CLL的3期头对头试验;5)泽尼达妥单抗(HER2双抗)将与Zymeworks/Jazz合作开展的用于HER2+GC一线治疗的3期试验,预计将进行主要无进展生存期数据读出。2026:BGB-43395(CDK4抑制剂)启动针对HR+/HER2-BC二线治疗的III期临床以及一线治疗的III期临床。
早期管线进展顺利。2025H2:1)BGB-58067(PRMT5抑制剂)和BG-89894(MAT2A抑制剂)预计完成联合用药试验的首例受试者入组;2)炎症与免疫治疗BGB-45035(IRAK4CDAC)预计完成2期试验的首例受试者入组;3)有望获得用于组织IRAK4降解的概念验证数据。
盈利预测与投资评级
我们预计2025-2027年的营业收入为380.00、459.10亿元和540.41亿元;考虑到公司核心产品持续放量,将2025-2027年的归母净利润从7.03、40.10和67.44亿元,上调至17.93、43.13和67.90亿元。维持“买入”评级。
风险提示:政策变动风险、全球市场风险、研发进度不及预期风险 |
||||||
| 9 | 浦银国际证券 | 阳景,胡泽宇 | 维持 | 买入 | 2Q25业绩再超预期,全年指引上调 | 2025-08-07 |
百济神州(688235)
公司2Q25业绩好于预期,公司轻微上调2025年收入、毛利率及现金流指引。维持“买入”评级,上调美股、港股和A股目标价。
2Q25收入、盈利均超预期:2Q25总收入为13.15亿美元(+41.6%YoY,+17.7%QoQ),包括产品收入13.02亿美元(+41.4%YoY,+17.5%QoQ),好于我们预期和VA(Visible Alpha)一致预期,主要由于泽布替尼海外销售强于预期。GAAP经营利润(OP)为8,789万美元,经调整经营利润为2.75亿美元;GAAP净盈利为9,432万美元,经调整净利润为2.53亿美元,连续两个季度实现GAAP经营利润和净盈利,高于我们之前预期和VA一致预期的盈利数字,主要由于收入及毛利率强于预期。得益于收入增长、海外收入占比提升以及生产效率提高,产品毛利率进一步提升至87.4%(+2.4ppts YoY,+2.2ppts QoQ),叠加经营效率的持续提升,2Q25公司经营性现金流入继续上升至2.64亿美元(vs.1Q25:4,408万美元),自由现金流上升至2.2亿美元。
公司略微上调2025年全年收入及毛利率指引,公司预计关税影响不明显:2025年总收入指引从原先的49-53亿美元上调至50-53亿美元,GAAP毛利率指引从原来的80%+中位区间上调至80%+中高位区间,现金流指引从原来的正向经营性现金流上调至正向自由现金流,而GAAP经营费用及GAAP经营利润仍维持原指引不变(即,GAAP经营费用为41-44亿美元,GAAP经营利润为正)。管理层表示,该收入及毛利率指引已将目前美国关税政策对于2025年的影响考虑在内,由于美国工厂的存在及全球化的供应链(泽布替尼DP在美国生产、API可在瑞士西班牙生产;TEVIMBRA Hopewell工厂可从2026年起供应美国),公司认为关税加征不会对短期产生明显影响。
泽布替尼海外销售强于预期,其中美国销售是最大驱动力,受益于年初药价提升中单位数幅度以及美国医保Part D改革正向影响。泽布替尼2Q25销售额达到9.5亿美元(+49%YoY,+20.0%QoQ),持续同比环比增长,其中美国销售继续强劲增长,达到6.84亿美元(+42.7%YoY,+21.4%QoQ),系最大驱动力,管理层表示美国的强劲增长部分受益于年初药价提升约4%以及美国Part D改革带来的正向销售影响(公司属于小型生产商认证,厂家共负担比例较小,使得净价格受影响较小)。欧洲泽布替尼实现1.5亿美元销售(+84.9%YoY,+29.9%QoQ),主要得益于包括德国在内的主要国家市场份额提升。中国泽布替尼销售亦持续增长至8,330万美元(+31.0%YoY,+2.7%QoQ)。
2H25及2026年研发催化剂丰富:(1)Sonrotoclax(BCL2抑制剂):目前中国已递交R/R CLL和R/R MCL适应症的NDA申请(基于二期试验数据),预计有望于1H26获得中国NMPA加速批准上市。2H25有望公布全球R/R MCL二期数据读出,并提交对应的全球加速审批NDA申请(若数据支持),最快有望于2026年全球上市。(2)BGB-16673(BTK CDAC)预计将于2H25启动三期在R/R CLL适应症上和Pirtobrutinib头对头临床试验(CaDAnce-304),将于2026年读出二期R/R CLL数据(CaDanCe-101)及提交对应的全球加速审批NDA申请(若数据支持),最快有望于2027年全球上市。(3)泽尼达妥单抗(HER2双抗):2H25有望读出1L HER2+胃食管腺癌3期PFS数据。(4)泽布替尼:2H25预计将读出MANGROVETN MCL3期PFS中期分析数据及片剂有望在欧洲获批。(5)TEVIMBRA:2H25有望获得(新)辅助肺癌欧洲获批。(6)早期资产方面,BGB-43395(CDK4抑制剂)预计将于2026年启动HR+/HER2-BC2L及1L的两项三期试验,其余多款早期资产均预计于2H25公布POC数据,包括泛KRAS抑制剂、EGFR CDAC、CDK2抑制剂、B7H3ADC、CEA ADC、FGFR2bADC、IRAK4CDAC和PRMT5抑制剂。
维持“买入”评级,上调美股、港股和A股目标价。基于公司盈利进度快于预期,我们将2025E/2026E/2027E经调整Non-GAAP净利润分别上调至8.4/9.5/12.1亿美元,主要由于轻微上调收入及毛利率预测。基于DCF估值方法(WACC:7.5%,永续增长率:3%),维持“买入”评级,分别上调美股、港股和A股目标价至349美元、211港元、276元。
投资风险:泽布替尼海外销售增速未如预期;核心研发管线临床/审批延误或数据不及预期;中美地缘政治摩擦加剧。 |
||||||
| 10 | 天风证券 | 杨松,曹文清 | 维持 | 买入 | CDK4抑制剂展现出优异早期疗效信号,后续将进入注册临床研究阶段 | 2025-07-08 |
百济神州(688235)
百济神州的CDK4抑制剂BGB-43395进度处于前列,有望成为全球第二款进入注册临床阶段的CDK4抑制剂
根据公司指引,BGB-43395预计在未来的6-12个月内进入注册临床阶段。BGB-43395目前开展了3项I期临床,试验方案涵盖了单药或联合内分泌疗法(ET,Endocrine Therapy)二线治疗,以及联合ET和BCL2i三线治疗HR+/HER2-BC。
CDK4抑制剂BGB-43395在多个体内外药效评估中均展现出BIC潜力BGB-43395相较现有CDK4/6抑制剂具有更高选择性。BGB-43395在GLP毒理研究中表现良好,未见显著中性粒细胞减少或胃肠道毒性。百济神州的BGB-43395体内药代动力学数据符合预期,药效学活性强效。
CDK4抑制剂BGB-43395具有更优抑制效力。目前CDK4i领域FIC的药物是进入III期临床的辉瑞的PF-07220060,在MCF-7增殖实验中,BGB-43395的抑制细胞增殖效力IC50为126nM,比PF-07220060更强(后者为544nM),活性提升4.3倍,展现出卓越疗效。
后续随访时间延长,整体响应率有望大幅提升
从辉瑞披露的数据可以看到,CDK4抑制剂Atirmociclib的中位起效时间是3.6M。所以对同靶点药物,百济神州的CDK4i来说,3个月的中位随访时间还未到中位起效时间。过往数据提示CDK4/6i的应答率随时间延长逐步提升,在9个月时达到最高应答概率。BGB-43395在3个月的评估时间看到240mg、400mg、600mg BID联用组SD+PR为67%(8/12),83%(5/6),75%(6/8),趋势较好。
盈利预测与投资评级
我们预计2025-2027年的营业收入为375.17、450.24和540.34亿元;预计2025-2027年的归母净利润7.03、40.10和67.44亿元。维持“买入”评级。风险提示:公司产品商业化进度不及预期风险、政策变动风险、研发进展不及预期风险、核心技术人员流失风险、市场竞争加剧风险 |
||||||
| 11 | 西南证券 | 杜向阳,王彦迪 | 首次 | 买入 | 生物科技出海明星,2025年迎来蝶变 | 2025-06-24 |
百济神州(688235)
投资要点
推荐逻辑:1)泽布替尼出海标杆,2024年收入26亿美元(+105%),预计全球销售额有望持续增长。2)在研Bcl-2i和BTK CDAC于2025年迎来多项催化事件,未来依托泽布替尼全球商业化渠道,拓宽加深血液瘤市场覆盖。3)早期管线陆续迎来概念验证。在研CDK4i目标百亿市场,全球进度前二,有望于2025年上半年首次读出概念验证数据。此外PanKRASi、EGFR CDAC、CDK2i、多项ADC有望于2025年下半年首次读出概念验证数据。
百济神州国内药企出海标杆,预计公司25年有望盈利。百济神州于2010年创立,是美股+H股+A股三地上市的创新药企业。2024年百济神州实现收入38亿美元(约合人民币272亿元,+56%),核心产品泽布替尼实现收入26亿美元(+105%),推动公司亏损额持续收窄。公司于2025年JPM大会宣布当年目标实现营运利润为正。
泽布替尼问鼎百亿市场,全球快速放量。全球BTKi市场规模超百亿美元。公司的BTK抑制剂泽布替尼是第一个获美国FDA批准的中国自主研发的抗癌药。泽布替尼用于一线治疗CLL的5年PFS率为79%,较竞品优势显著,此外其在MCL、WM等适应症亦取得优秀数据,较伊布替尼展现优势。目前泽布替尼美国CLL新患占比第一,有望逐步替代伊布替尼,借助患者留存效应逐步扩大市场份额。全球处在研发阶段的BTK抑制剂(血液瘤适应症)包括礼来匹妥布替尼和默沙东nemtabrutinib,均尚未获批一线CLL适应症。我们预计泽布替尼美国市场地位稳固,销售增长空间广阔。
血液瘤梯队完整,有望基于泽布替尼渠道拓展市场。公司长期布局Bcl-2i和BTKCDAC两大品种。2025年公司Bcl2i Sonrotoclax有望完成首个注册临床研究。2024年公司于多个血液瘤会议披露BTK CDAC多项1期研究亮眼数据,已于2025年初启动注册3期研究。公司依托泽布替尼全球商业化渠道,拓宽加深血液瘤市场覆盖。
早期管线陆续迎来概念验证。2024年全球CDK4/6i销售超过100亿美元。CDK4i提升血液学安全性的确定性高,有希望将其相对CDK4/6i安全性优势转化为用药时长和有效性优势。公司预计在研CDK4i有望于2025年上半年首次读出概念验证数据,并于2025年内启动注册三期研究。PanKRASi、EGFR CDAC、CDK2i、多项ADC有望于2025年下半年首次读出概念验证数据。
盈利预测与投资建议。预计公司2025-2027年收入分别为359亿元、441亿元、520亿元。我们选取了行业中与百济神州业务较为相近的四家公司,2025年四家公司平均PS为19倍;公司泽布替尼已成功在美国独立商业化,增长空间广阔,我们给予百济神州15倍PS,对应目标价348.82元/股,首次覆盖,给予“买入”评级。
风险提示:临床数据不及预期、海外市场拓展不及预期、竞争格局恶化等风险。 |
||||||
| 12 | 天风证券 | 杨松,曹文清 | 维持 | 买入 | 2025 Q1首次实现季度GAAP净利润转正,泽布替尼放量稳定 | 2025-05-29 |
百济神州(688235)
事件:
公司发布2025年第一季度报告,2025年第一季度总收入11.17亿美元,同比增长49%;GAAP经营利润为1110万美元,首次转正;经调整经营利润为1.39亿美元,同比增长195%;GAAP净利润为127万美元,首次转正。
各费用率逐季降低,降本增效,实现首次季度GAAP净利润盈利2025Q1GAAP研发费用为4.82亿美元,研发费用率分别为43%,同比减少18pct,环比减少5pct;非GAAP研发费用为4.21亿美元,研发费用率为38%,同比减少16pct,环比减少4pct。2025Q1GAAP销售及管理费用为4.59亿美元,对应费用率为41%,同比减少16pct,环比减少4pct;非GAAP销售及管理费用为3.96亿美元,对应费用率为35%,同比减少14pct,环比减少3pct。与GAAP指标相比,2025Q1经调整后指标在研发费用和销售及管理费用中分别减去4177万和5368万美元的股权激励成本以及1893万和1008万美元的折旧费用,此外在销售及管理费用中还减去了1.7万的无形资产摊销费用。
泽布替尼美国正常季度波动,看好全年销售放量
2025Q1泽布替尼的总收入为7.92亿美元,同比增长62%,环比下滑4.3%。分地区来看,美国的产品收入为5.63亿美元,同比增长超过60%,环比减少8.6%;在欧洲的第一季度销售额为1.16亿美元,同比增长73%,环比增加2.7%。美国环比下滑,一方面历年第一季度都是增长较弱的季度,同类别抑制剂2025Q1环比均有所下滑;另一方面去年第四季度有3000万美金一次性订单的收入确认。
公司另一重要商业化产品替雷利珠单抗稳定放量。2025Q1总收入为1.71亿美元,同比增长18%,环比增长11%。
预计将有多个概念验证里程碑读出,核心管线研发进程顺利
2025年将进入富有催化意义的重要时期,预计有10余个概念验证里程碑读出。包括乳腺及妇科领域的CDK4抑制剂、CDK2抑制剂和B7H4ADC,肺部疾病领域的EGFR-CDAC,泛KRAS抑制剂和PRMT5抑制剂,胃肠道领域的FGFR2b ADC和CEA ADC,以及免疫治疗和炎症领域的IRAK4CDAC。
BGB-16673与包括FDA在内的全球监管机构就III期研究给药剂量达成一致。已启动针对R/R CLL患者的3期临床试验(对比医生选择方案),且预计将于2025年下半年开展与匹妥布替尼的III期头对头试验。在2025EHA大会上公布更新的数据显示,在中位随访时长为13.1个月时,BGB-16673对于中位治疗线数为4线的R/R CLL/SLL患者,ORR可以达到80.3%,mPFS尚未成熟。
Sonrotoclax的III期CELESTIAL-TNCLL临床试验已完成入组,已在中国提交R/R CLL加速批准申请,预计将于2025年下半年提交R/R MCL全球申报。在2025年EHA大会上公布的最新数据显示,Sonrotoclax在复发/难治性CLL/SLL患者中表现优异。以uMRD4(即MRD<10^-4,微小残留病未检出)为评价指标,第48周时,160mg、320mg和640mg组的uMRD4率分别达到100%、71%和83.3%。
盈利预测与投资评级
我们预计2025-2027年的营业收入为375.17、450.24和540.34亿元;预计2025-2027年的归母净利润7.03、40.10和67.44亿元。维持“买入”评级。风险提示:政策变动风险、全球市场风险、研发进度不及预期风险 |
||||||
| 13 | 浦银国际证券 | 阳景,胡泽宇 | 维持 | 买入 | 一季度提前实现GAAP OP及净盈利 | 2025-05-09 |
百济神州(688235)
公司1Q25收入符合预期,提前实现季度GAAP OP及净盈利略好于预期。维持“买入”评级,维持美股、港股和A股目标价基本不变。
1Q25收入符合预期,提前实现季度GAAP OP盈利及净盈利略好于预期,公司维持全年指引不变:1Q25总收入为11.2亿美元(+48.6%YoY,-0.9%QoQ),包括产品收入11.1亿美元(+48.4%YoY,-0.9%QoQ),大致符合我们预期和VA(Visible Alpha)一致预期。GAAP口径实现净盈利127万美元(vs.1Q24:2.51亿美元净亏损,4Q24:1.52亿美元净亏损),好于我们之前预期的轻微亏损和VA一致预期的净亏损,主要由于经营费用低于我们及VA一致预期,使得公司于1Q25提早实现GAAP OP(经营利润)1,110万美元(vs.1Q24:2.61亿美元亏损,4Q24:7,943万美元亏损)。因此,1Q25成功成为公司首个实现GAAP OP和净盈利的季度,早于市场预期。此外,得益于收入持续增长及经营效率持续提升,1Q25公司产生4,408万美元的经营性现金流入。展望2025年全年,公司维持全年营收和费用指引不变(即总收入为49-53亿美元,毛利率预计在80%-90%区间中位,GAAP经营费用为41-44亿美元,全年GAAP经营利润为正,经营活动产生现金流为正)。
泽布替尼海外销售持续高速增长。泽布替尼1Q25销售额达到7.92亿美元(+62.1%YoY,-4.4%QoQ),同比提升明显,环比略微下降主要由于4Q24存在约3千万美元提前购药的影响。按地区来看,泽布替尼美国销售额为5.63亿美元(+60.2%YoY,-8.6%QoQ),主要得益于CLL适应症的扩大使用(超过60%的季度环比增长由此贡献),市场份额持续提升。公司表示,尽管美国供货端1Q25由于4Q24提前购药略有下降,但需求端仍然在1Q25看到6%的环比增速,好于其他竞争对手;欧洲销售额为1.16亿美元(+73.5%YoY,+2.3%QoQ),主要得益于欧洲主要市场份额提升(德国、意大利、西班牙、法国和英国);中国销售额为81.1亿美元(+41.3%YoY,+17.0%QoQ)。另外,替雷利珠单抗一季度亦实现双位数的销售增长,达到1.71亿美元(+17.8%YoY,+11.3%QoQ)。
毛利率符合预期,经营效率持续提升。如我们所料,产品毛利率为85.1%,同比上升明显,环比较为稳定(vs.1Q24:83.3%,4Q24:85.6%),主要受益于泽布替尼海外销售持续增长推动,以及生产效率的提升。另外,在收入大幅同比提升背景下,公司经营费用继续维持强有力的控制,整体仅增长6%YoY(即使剔除1Q243,500万美元相关的BD研发费用,整体经营费用仍仅增长10%YoY),其中研发费用增长5%YoY至4.8亿美元,销售及管理费用增长7%至4.6美亿元(主要由于对泽布替尼美国欧洲商业化拓展的持续投入)。
主要管线产品研发进展顺利,近期重点关注ASCO大会即将公布的B7H4ADC和CDK2抑制剂首次人体数据及1H25将公布的CDK4抑制剂POC数据读出,2H25有望迎来Sonrotoclax全球2期MCL数据读出及多项早期资产POC数据读出。(1)Sonrotoclax(BCL2抑制剂):目前中国已递交R/R CLL适应症的NDA申请(基于2期试验数据),预计有望于1H26获得中国药监局加速批准上市。此外,全球三期CELESTIAL-TNCLL入组目前已完成(N=640),第二项三期试验CELESTIAL-RRMCL已开展(1Q25已完成首例患者入组),第三项三期试验CELESTRIAL-RRCLL有望于6月开始病人招募,符合公司此前指引。2H25有望公布全球R/R MCL二期数据读出,并进行对应的全球加速审批NDA申请(若数据支持),最快有望于2026年全球上市。(2)BGB-16673(BTK CDAC)已启动R/RCLL三期CaDAnce-302临床试验,预计将于2H25启动三期在R/R CLL适应症上和Pirtobrutinib头对头临床试验(CaDAnce-304),将于2026年读出二期R/R CLL数据,若数据积极,最快有望于2027年全球上市(通过加速审批路径)。(3)泽尼达妥单抗(HER2双抗):2H25有望读出1LHER2+胃食管腺癌3期PFS数据。(4)泽布替尼:2H25预计将读出MANGROVE TN MCL3期PFS中期分析数据。(5)TEVIMBRA:2H25有望获得1L NPC欧洲获批,(新)辅助肺癌欧洲获批,2026年有望获得日本1L GC获批。(6)早期资产方面,BG-68501(CDK2抑制剂)和BG-C9074(B7H4ADC)将于ASCO大会读出首次人体数据,BGB-43395(CDK4抑制剂)预计将于6月底公司研发日读出POC数据(主要是缓解率及PK安全性数据),其余多款早期资产均预计于2H25公布POC数据,包括泛KRAS抑制剂、B7H4ADC、EGFR CDAC、CDK2抑制剂、B7H3ADC、CEAADC、FGFR2b ADC、IRAK4CDAC和PRMT5抑制剂。
重申“买入”评级,维持美股、港股和A股目标价基本不变。我们将2025E净盈利略微提升至1.1亿美元,主要由于轻微下调销售行政费用预测,维持2026E/2027E净盈利预测基本不变。基于DCF估值方法(WACC:7.6%,永续增长率:3%),维持“买入”评级,维持美股、港股和A股目标价基本不变(美股目标价324美元,港股目标价194港元,A股目标价人民币274元)。
投资风险:泽布替尼海外销售增速未如预期;核心研发管线临床/审批延误或数据不及预期;中美地缘政治摩擦加剧。 |
||||||
| 14 | 中国银河 | 程培,闫晓松 | 首次 | 买入 | 百济神州2024年年度报告业绩点评:海外放量超预期,创新管线迎来拐点 | 2025-05-08 |
百济神州(688235)
事件:2025年4月29日,百济神州发布2024年年度业绩报告,2024全年公司实现营业收入272.14亿元(+56.19%);归母净亏损49.78亿元,亏损同比收窄25.87%;扣非归母净亏损53.79亿元,亏损同比收窄44.44%; 经营性现金流-12.59亿元。2024Q4单季度公司实现营业收入80.78亿元(+77.61%);归母净亏损12.92亿元,亏损同比收窄54.49%;扣非归母净亏损13.89亿元,亏损同比收窄52.08%; 经营性现金流+5.82亿元。
核心产品海外放量超预期,25年指引经营性现金流转正。2024年全年公司营业收入同比增长56.19%,归母净亏损同比收窄25.87%,主要系核心产品泽布替尼海外持续商业化放量。目前泽布替尼已在全球70多个市场获批上市,累计治疗超过18万例患者;2024年泽布替尼全球销售额同比大幅增长105%,其中美国市场贡献77%,销售额同比增长106%,泽布替尼在美国CLL新患市场处方量排名第一;欧洲市场贡献14%,销售额同比增长194%,在欧洲多个国家和地区重要市场持续扩张。基于泽布替尼在美国市场的领先地位,以及欧洲和全球其他市场渗透率逐步提升,公司预计2025年全年营业收入将达352-381亿元区间,有望超过营业成本和各项费用之和,预计2025年将实现经营性现金流转正。
血液瘤领域领先地位进一步巩固。公司在血液瘤领域持续推进后续管线研发进展,其中BCL2抑制剂sonrotoclax具备全球同类最佳潜质,有望在2025年下半年递交单药治疗R/R CLL/SLL和R/R MCL的加速上市申请;同时联合泽布替尼一线治疗CLL/SLL的全球Ⅲ期临床CELESTIAL研究已完成患者入组。另一款具备全球同类最佳降解剂潜质的BTK CDAC抑制剂 BGB-16673有望在2025年下半年启动与BTK抑制剂匹妥布替尼的“头对头”Ⅲ期临床,用于治疗R/R CLL/SLL。
多项自主研发管线迎来价值拐点。2024年公司共推进13个新分子进入临床开发阶段,以创新治疗模式加速布局肺癌、乳腺癌、胃肠道癌等实体瘤领域;目前多个创新分子将于2025年披露PoC数据,即将迎来价值拐点;包括治疗乳腺癌的新一代CDK4抑制剂BGB-43395、针对多种KRAS突变实体瘤的panKRAS抑制剂BGB-53038、潜在的同类首创B7H4 ADC BG-C9074、针对三代EGFR-TKI敏感和耐药均有效的EGFR CDAC BGB-60366等。
投资建议:百济神州作为聚焦创新药研发生产和全球商业化的龙头企业,其核心产品具备同类最佳特质,血液瘤领导地位进一步巩固,多项自主研发管线即将迎来价值拐点。我们预计公司2025-2027年的营业收入分别为368.04/462.79/536.50亿元;归母净利润分别为3.40、30.17、64.48亿元,经过DCF估值模型测算,我们认为公司合理市值市值区间为3217.50-5006.78亿元。首次覆盖,给予“推荐”评级。
风险提示:研发管线进展不及预期的风险;产品商业化不及预期的风险;市场竞争加剧的风险:政策变动的风险 |
||||||
| 15 | 东吴证券 | 朱国广 | 维持 | 买入 | 2024年年报点评:营收大幅增长,2025年将迎来 GAAP经营性利润转正 | 2025-05-05 |
百济神州(688235)
投资要点
事件:公司4月底发布2024年年报,公司2024年实现收入272.1亿元,同比+56.2%。归母净利润-49.8亿元,进一步减亏,全年实现非GAAP经营性利润为正。得益于泽布替尼全球销售的快速增长,业绩略超市场预期。公司2025年全年收入指引为49亿至53亿美金,GAAP经营性利润转正。
泽布替尼全球销售快速增长,BCL2抑制剂和BTK CDAC巩固血液瘤领军地位。泽布替尼2024年全球销售额26亿美金,同比+105%;美国销售额20亿美金,同比+106%;欧洲销售额3.59亿美金,同比+194%。泽布替尼目前已在70+市场获批,在美国CLL新患者治疗中处于领先地位。BCL2抑制剂具备同类最佳潜力,针对r/r CLL适应症国内已成功报产并纳入优先审评程序;联合泽布替尼治疗1L CLL的全球3期临床试验已完成入组。BTK CDAC是全球临床进度最快的BTK降解剂,有望2025H2启动与非共价抑制剂匹妥布替尼用于r/r CLL的3期“头对头”试验。
实体瘤管线推进迅速,掀起下一波创新浪潮。2024年推进13个创新分子进入临床开发阶段,加速肺癌、乳腺癌、胃肠道肿瘤的快速布局。预计CDK4抑制剂、CDK2抑制剂和B7H4ADC将于2025H1进行数据读出。
盈利预测与投资评级:由于泽布替尼海外竞争格局较稳定,全球销售强劲增长,叠加替雷利珠单抗欧美均开启商业化,我们预计公司整体营收未来三年保持快速增长,三费费用控制合理,扭亏后有望快速释放利润。我们将2025-2026年的归母净利润-2.74亿元和6.36亿元分别上调至4.03亿元和35.9亿元。预计2027年归母净利润为67.5亿元,对应2025-2027年PE估值为857/96/51X。公司作为国内创新药龙头,临床开发效率卓越,全球商业化能力突出,成长确定性较高,财务报表端即将扭亏,维持“买入”评级。
风险提示:临床数据不佳风险;竞争格局加剧风险;商业化不及预期风险。 |
||||||
| 16 | 中山证券 | 赖菲虹 | 百济神州业绩快报点评:业绩高双位数增长,2025预计实现GAAP盈利 | 2025-03-17 | ||
百济神州(688235)
主要观点:
业绩符合预期,营收表现良好。2025年2月28日,百济神州发布2024年度业绩快报,预计2024年全年公司实现营业收入38.10亿美元(同比+55%),GAAP经营净亏损5.68亿元(同比减亏6.40亿美元),非GAAP经营利润4535.6万美元(同比扭亏为盈)。公司2024年全年实现产品收入37.80亿美元(同比+73%),产品收入的增长主要得益于百悦泽(泽布替尼胶囊),以及安进授权产品和百泽安(替雷利珠单抗)的销售增长。
核心产品加速放量,市场份额持续提升。根据公司官方微信公众号:百泽安(替雷利珠单抗)2024年销售额为6.21亿美元,同比增长16%。目前美国FDA正在审评百泽安用于一线治疗ESCC患者的新增适应症上市许可申请,日本药品和医疗器械管理局(PMDA)正在审评百泽安用于一线和二线治疗ESCC的上市许可申请,商业化进程不断加速。百悦泽(泽布替尼)2024年全年销售额为20亿美元,同比增长106%。在欧洲,百悦泽销售额为3.59亿美元,同比增长194%,主要得益于在德国、意大利、西班牙、法国等主要市场的份额提升,CLL领域的领先地位持续巩固。
多个临床数据等待读出,新一波管线进入密集收获期。根据公司官方微信公众号,由公司自主开发的高选择性Bcl-2抑制剂Sonrotoclax(BCL2抑制剂)在治疗CLL等血液肿瘤方面显示出显著疗效和良好的安全性,公司计划对R/R CLL和R/R MCL的2期研究进行数据读出,并有望于2025年下半年基于这两项适应症递交潜在加速批准申请。BGB-16673(BTK CDAC)用于治疗R/RCLL的潜在注册性2期研究继续入组患者,预计将于2026年读出数据。2024年百济神州共推动13款新分子进入临床,是2023年的2.6倍,且超过了之前指引的12个新分子。
首次提供明确盈利指引,预计2025年实现GAAP净利润转正。公司于2025年1月13日(美国东部时间)参加JPM医疗健康大会时首次提供了明确盈利指引,预计将实现2025年全年GAAP净利润(经营利润)为正。同时公司于2025年2月发布公告,提供了正式的2025年业绩指引,预计2025年实现营业收入352-381亿元人民币(同比+29.35%-40.00%),同时再次申明2025年GAAP经营性净利润和经营活动产生的现金流量净额预计为正。基于公司2024年业务进展和2025年业绩指引,我们预期公司2025年在商业化和财务报表上保持强劲表现。
风险提示:临床进展不及预期风险,商业化不及预期风险。 |
||||||
| 17 | 天风证券 | 杨松,曹文清 | 维持 | 买入 | 2025年将实现GAAP口径下经营利润为正,实体瘤领域多款早研分子将POC | 2025-03-16 |
百济神州(688235)
事件:
近日公司在美股和港股市场发布2024全年及2024年第四季度主要财务数据:2024年全年总收入38.10亿美元,同比增长55%,净亏损-6.45亿美元,同比减亏27%;2024年第四季度总收入11.28亿美元,同比增长78%,净亏损-1.52亿美元,同比减亏59%。2024年全年和第四季度经调整营业利润分别为4536万和7860万美元,实现首次全年非GAAP经营利润盈利。且公司重申预计2025年GAAP经营利润为正。
销售管理费用率逐季降低,实现首次全年NON-GAAP经营利润盈利2024全年GAAP和非GAAP研发费用分别为19.53亿和16.68亿美元,研发费用率分别为51%和44%,同比分别减少21pct和20pct。2024全年GAAP和非GAAP销售及管理费用为18.31亿和15.50亿美元,对应费用率为48%和41%,同比减少13pct和12pct。与GAAP指标相比,2024全年经调整后指标在研发费用和销售及管理费用中分别减去1.86亿和2.56亿美元的股权激励成本以及9881万和2542万美元的折旧费用,此外在销售及管理费用中还减去了9.5万的无形资产摊销费用。
2024Q4研发费用为5.42亿美元,研发费用率为48%,同比减少30pct,环比减少1pct。2024Q4销售及管理费用为5.05亿美元,对应费用率为45%,同比减少21pct,环比减少1pct。经调整后2024Q4研发费用为4.75亿美元,研发费用率为42%,同比减少27pct,环比略增2pct;经调整后2024Q4销售及管理费用为4.33亿美元,对应费用率为38%,同比减少19pct,环比持平。
2024全年核心品种泽布替尼同比增长超100%,美国保持环比快速增长2024全年泽布替尼全球销售收入26.4亿美元,同比增长105%;2024Q4收入8.28亿美元,同比增长100%,环比增长20%。分地区来看,美国地区销量持续高增长,2024Q4和全年收入分别为6.16亿和20亿美元,同比分别增长97%和106%,2024Q4环比增长22%,其中60%以上的季度环比增长来自于其在CLL患者中的扩大使用;欧洲地区2024Q4和全年收入为1.13亿和3.59亿美元,同比增长148%和194%,2024Q4环比增长16%,其在欧洲所有主要市场的市场份额增加。
替雷利珠单抗两项新适应症纳入2024年医保目录,并持续扩张全球版图2024Q4和2024全年替雷利珠单抗总收入分别为1.54亿和6.21亿美元,同比增长20%和16%。鼻咽癌和胃或胃食管结合部腺癌的一线适应症治疗被纳入2024年医保目录。此外,2024Q4,替雷利珠单抗在美国新增获批胃癌一线治疗适应症,在EMA新增获批胃癌和食管鳞癌的一线治疗适应症。BGB-16673和Sonrotoclax的开发计划正在稳步推进中
BGB-16673关于头对头医生选择的治疗方案和匹妥布替尼用于治疗R/RCLL的2项III期临床试验,预计将分别于2025年上半年和下半年启动。Sonrotoclax用于R/R CLL和R/R MCL的II期临床数据将读出,并有望于2025年下半年基于这两项适应症提交加速批准申请,同时这两项适应症的III期临床预计将在2025年上半年完成首批患者入组。TN CLL适应症的III期临床已完成入组。
盈利预测与投资评级
考虑到公司收入增长超预期,我们将2024-2026年收入从265.03、338.04和410.11亿元上调至272.14、375.17和450.24亿元;2024年归母净利润为-49.78亿元,将2025-2026年归母净利润从-0.54和14.03亿元上调至7.03和40.10亿元。维持“买入”评级。
风险提示:政策变动风险、全球市场风险、研发进度不及预期风险、报告中部分财务数据未经审计,请以公司正式财报为准 |
||||||
| 18 | 浦银国际证券 | 阳景,胡泽宇 | 维持 | 买入 | 2025年收入指引强于市场预期,重申GAA POP盈利指引 | 2025-03-03 |
百济神州(688235)
维持“买入”评级,上调目标价至美股324美元,港股194港元,A股人民币273元。
4Q24业绩符合预期,连续三个季度实现Non-GAAP OP盈利:4Q24公司产品收入达到11.18亿美元(+77.3%YoY,+12.5%QoQ),大致符合Visible Alpha(VA)一致预期和我们预期,其中泽布替尼销售好于VA和我们预期;净亏损为1.52亿美元(-58.7%YoY,+25.2%QoQ),符合我们预期,尽管略高于VA预期。受益于强劲的泽布替尼海外销售,4Q24产品毛利率为85.6%(+2.4ppts YoY,+2.8ppts QoQ)。百济连续三个季度实现经调整NON-GAAP OP(Operating Profit,经营利润),4Q24实现7,860万美元盈利,在2Q/3Q24基础上进一步提升,符合我们预期。受益于GAAP OP缩窄(或Non-GAAP OP盈利提升),4Q24实现经营现金流净流入7,516万美元,较4Q23(约2.2亿美元净流出)显著改善。
2025年收入指引强劲,好于市场预期,重申2025年实现GAAP OP盈利:如公司此前所言(详情请见我们先前报告),公司在此次业绩会上提供了详细的2025年指引:(1)总产品收入指引为49-53亿美元(+29.6%~40.2%YoY),高于VA预期(+27%YoY)及我们原先预期(+21%YoY);(2)GAAP经营费用为41-44亿美元(+8.3%YoY~16.3%YoY),大致符合VA预期和我们原先预期;(3)GAAP毛利率在80%+中位数区间(vs.FY2024:84.3%),符合VA预期和我们预期;(4)全年实现GAAPOP盈利;及(5)经营活动现金流实现净流入。我们认为,超出市场预期的强劲收入增速显示出百济强大的海外商业化能力,有助于在目前乐观市场行情背景下进一步提振投资者对于公司股票的情绪。
泽布替尼海外销售持续强劲增长:泽布替尼4Q24全球销售额达到8.28亿美元(+100.5%YoY,+20.0%QoQ),略超出我们预期,其中美国销售额达6.16亿美元(+96.7%YoY,+22.3%QoQ),好于我们此前保守预测的5.62亿美元,部分受益于3,000万美元季节性因素的正面影响。若剔除季节性因素影响,4Q24泽布替尼美国销售环比提升13%(3Q24同样剔除2Q24提前购药的季节性因素导致的负面影响)。此外,欧洲销售额达1.13亿美元(+147.8%YoY,+16.4%QoQ),得益于主要国家市场份额有所增加(德国、意大利、西班牙、法国、英国)。泽布替尼于2024年全年共计实现收入26.4亿美元(+104.9%YoY),展望2025年,得益于欧洲市场的持续拓展和美国市场份额的进一步提升,泽布替尼有望持续强劲增长,我们预测其可实现约37亿美元收入(+39%YoY)。
产品研发进展顺利,2025年有望迎来多项研发催化剂:(1)Sonrotoclax(BCL2抑制剂)有望于2H25公布全球R/R MCL和中国R/RCLL二期数据读出,并进行对应的加速审批NDA申请(若数据支持)。Sonrotoclax全球三期CELESTIAL-TN CLL入组目前已完成(N=640)。此外,公司有望于1H25开启R/R CLL和R/R MCL的三期研究。(2)BGB-16673(BTK CDAC)预计1H25启动R/R CLL三期临床试验,2H25启动三期在R/R CLL适应症上和Pirtobrutinib头对头临床试验,2026年有望读出二期R/R CLL数据。(3)TEVIMBRA有望于1H25获得美国1L ESCC批准及日本1L和2L ESCC批准,于2H25获得3项欧洲批准(1L NPC,1L SCLC,辅助/新辅助NSCLC)。(4)早期资产方面,BGB-43395(CDK4抑制剂)预计将于1H24读出POC数据,BG-C9074(B7H4ADC)和CDK2抑制剂将于2025ASCO上读出初步数据,其余多款早期资产均预计于2H25公布POC数据,包括泛KRAS抑制剂、B7H4ADC、EGFR CDAC、CDK2抑制剂、B7H3ADC、CEA ADC、FGFR2b ADC和IRAK4CDAC。
维持“买入”评级,上调目标价至美股324美元,港股194港元,A股人民币273元:我们将2025E/2026E收入分别上调约6%/7%,主要受益于泽布替尼海外销售预测提升,同时我们略微上调毛利率预测,因此2025E由此前盈亏平衡至轻微净利润,2026E净盈利较此前预测略有提升。同时,我们引入2027E预测。另外,考虑到目前乐观的市场情绪及公司正逐步迈入更成熟阶段,我们将WACC预测由先前8%下调为7.6%,因此,基于DCF估值方法,我们上调美股/港股/A股目标价至324美元/194港元/人民币273元,维持“买入”评级。
投资风险:泽布替尼海外销售增速未如预期;核心研发管线临床/审批延误或数据不及预期。 |
||||||
| 19 | 平安证券 | 叶寅,何敏秀,韩盟盟 | 首次 | 增持 | “国际化基因”创新药企标杆,朝向BioPharma加速转型 | 2025-02-22 |
百济神州(688235)
平安观点:
“国际化基因”创新药企标杆,差异化研发布局、高效高质团队、全球化销售网络引领公司加速壮大。公司成立于2010年,历经十多年逐步从一家Biotech成长为综合性全球化企业,是国内首家纳斯达克、港股、科创板三地上市创新药企。公司拥有一支全球化背景、行业经验深厚的管理团队,发展初期公司与全球多家药企如Celgene、安进、诺华等建立战略合作,在早期即体现公司“国际化视野”。公司不断完成创新药企“销售体系0-1搭建”、“自研管线0-1突破”等挑战:
(1)就销售体系而言,2017年公司收购Celgene国内的商业运营业务,并以此为基础搭建国内销售团队,2019年起公司自研产品替雷利珠单抗(PD-1)、泽布替尼(BTK抑制剂)、帕米帕利(PARP抑制剂)国内先后上市,与此同时国内销售团队不断成熟壮大;2019年泽布替尼在美获批上市,实现国内创新药出海“零突破”的同时,也驱动着公司海外高效销售网络的搭建,截至2024H1公司全球商业化团队规模超过3700人。
(2)就研发体系而言,公司致力于First in Class创新产品研发,持续挖掘成熟产品创新价值,同时积极布局创新技术和创新靶点。代表重磅产品如泽布替尼在头对头第一代BTK抑制剂伊布替尼显示出优效;替雷利珠单抗截至24年底国内已获批14项适应症,是国内获批数量最多的PD-1产品,且已在欧美获批上市并开启商业化销售。公司强化产品矩阵布局,血液瘤领域,手握BTK抑制剂泽布替尼、BCL2抑制剂和BTK CDAC;实体瘤领域,布局下一代IO疗法、新技术新靶点等,有望解决现有疗法面临的耐药性或安全性欠缺等问题。
自研产品高速放量带动公司盈利能力提升,预计2025年公司全年经营利润为正。(1)泽布替尼:自2019年在美获批上市以来,商业化销售放量强劲。2021年-2024年前三季度泽布替尼全球销售额分别为2.18/5.65/12.9/18.16亿美元,美国地区销售收入占泽布替尼全球销售大头,2024前三季度美国/欧洲/中国地区销售份额分别为73.5%/13.5%/10.5%。(2)替雷利珠单抗:2019年国内获批上市,2021-2024前三季度国内销售额分别为2.55/4.23/5.37/4.67亿美元,同比增速分别为56%/66%/27%/14%;此外截至24年底公司PD-1已在欧洲获批6项适应症,在美已获批2项适应症,海外销售未来可期。自主产品的快速放量带动了公司盈利和经营能力的提升,从毛利率来看,2021-2024前三季度公司产品毛利率分别为73.99%/77.17%/82.65%/83.71%;从经营利润来看,2024Q2、Q3延续两个单季度实现了非GAPP正收益,分别达0.48/0.65亿美元;从现金储备看,截至2024Q3公司现金储备27亿美元,相较2024Q2末增加1亿美元,表明公司在产品收入大幅增长下,已开始能够在大规模开展临床研发的同时自我“造血输血”,现金储备迎来未降反增的转折点。
深耕血液瘤搭建产品矩阵,2025年多项临床三期推进中。公司泽布替尼是全球首个头对头伊布替尼的BTK抑制剂,帮助其逐步夯实血液瘤领域领先地位。旗下BCL2抑制剂Sonratoclax有望与BTK抑制剂联用在一线治疗中进一步深化疗效,目前公司泽布替尼联合sonrotoclax1L CLL患者临床3期中,预计2025Q1入组完成,此外预计2025H1启动sonratoclax单药治疗R/R CLL和R/R MCL临床3期。针对耐药性问题,公司布局口服BTK CDAC,预计2025H1启动R/R CLL临床3期,且预计2025H2启动头对头非共价BTK抑制剂pirtobrutinib治疗R/R CLL临床3期。
实体瘤领域多项NME推向临床,高临床效率实现“快速概念验证“。2024年公司将13个新分子实体(NME)推进至临床开发阶段。2025年多项临床早期分子将披露PoC数据:CDK4抑制剂预计2025H1披露PoC数据,2025Q4开展1L和2LHR+乳腺癌临床3期研究;2025下半年CDK2抑制剂、EGFR CDAC、PanKras、IRAK4CDAC、B7H4ADC等将读出PoC数据。我们认为公司高效临床团队有望帮助早期分子实现“快速概念验证”。
投资建议:百济神州作为国内首家创新药出海企业,核心品种泽布替尼全球布局销售且已突破十亿美元销售收入,公司针对血液瘤全方位布局,就实体瘤研发探索下一代肿瘤免疫疗法、ADC、双抗等新型技术。我们预计公司2024-2026年分别实现营收264.98/364.07/439.54亿元,归母净利润分别为-44.01/2.05/21.78亿元。公司在研发端前沿创新布局、在销售端搭建全球销售网络、在临床开发高质高效,首次覆盖给予“推荐”评级。
风险提示:药品审批不及预期风险;新药上市放量不及预期风险;知识产权相关风险;国家政策的影响风险等。 |
||||||

 微信公众号
微信公众号
 证券之星APP
证券之星APP